毒劇ドットコム
毒物劇物取扱者.com
複数条件の場合はキーワードの間にスペースを入れてください。例 特定毒物 劇物
毒物劇物取扱者試験問題
演習No.502
問題18
問題18
濃度40%の希硫酸(密度1.3g/cm3)のモル濃度(mol/L)として、適切なものは次のうちどれか。ただし、硫酸H2SO4の分子量は98とする。
解 説
選択肢(4)が適切です。
密度1.3g/cm3 ➡ 1cm3 の質量が$$ 1.3g$$です。
1.00×1000cm3×1.3g/cm3=1300g ……(1)
(1.0L=1000mLですから、1.3g×1000=1300g )
1300gのうち、40%が硫酸H2SO4ですから、
1300×0.4=520g ……(2)
硫酸の分子量は 1×2 + 32×1 + 16×4 = 98……(3)
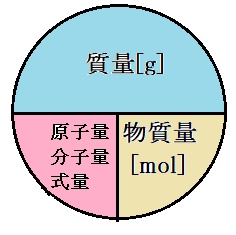
【モル質量:原子量、分子量、式量に単位[g/mol]を付けたもの】
すなわち硫酸H2SO4のモル質量は
98g/mol……(3)
H2SO4 520gの物質量は
\[ \begin{align*} \frac{520[g]}{98[g/mol]} \\ \\ \fallingdotseq 5.306[mol] \\ \\ \fallingdotseq 5.31[mol] \end{align*} \]
よって、モル濃度$(mol/L)$は、溶液$1L$中に溶けている溶質の物質量$(mol)$
\[ \begin{align*} モル濃度(mol/L) = \frac{溶質の物質量(mol)}{溶液の体積(L)} \end{align*} \]
で表されますので、
$\ce{5.31(mol/L)}$
となります。
-
物質量$[mol]$の求め方
\[ \begin{align*} 物質量[mol] &= \frac{粒子の数}{6.0\times 10^{23}[/mol] } \\ \\ &= \frac{質量[g]}{モル質量[g/mol]} \\ \\ &= \frac{気体の体積(標準状態)[L]}{22.4[L/mol]} \\ \end{align*} \] アボガドロ定数$\ce{N_{A} = 6.0 \times 10^{23}(コ/mol)}$が分かりやすいです。
モル質量は、原子量・分子量・式量に単位$(g/mol)$をつけたもの
- 質量パーセント濃度$(\%)$
溶液中に溶けている溶質の質量の割合 \[ \begin{align*} \frac{溶質(g)}{溶液(g)} \times 100 (\%) \\ \end{align*} \]
- モル濃度$(mol/L)$
溶液$1L$中に溶けている溶質の物質量$(mol)$ \[ \begin{align*} \frac{溶質の物質量(mol)}{溶液の体積(L)} \\ \end{align*} \] - 質量モル濃度$(mol/kg)$
溶媒$1kg$中に溶けている溶質の物質量$[mol]$ \[ \begin{align*} \frac{溶質の物質量(mol)} {溶媒の質量(kg) } \end{align*} \]
- 溶液$1L=1000mL=1000cm^3$
Dokugeki.com hopes you will successfully complete poisonous and deleterious substance handler test.
I would be delighted if this website is helpful for you to obtain the license.
Fortune prefers a person who has prepared minds.
Copyright (C) Since 2015 毒物劇物取扱者.com All Rights Reserved.