毒劇ドットコム
毒物劇物取扱者.com
複数条件の場合はキーワードの間にスペースを入れてください。例 特定毒物 劇物
毒物劇物取扱者試験問題
ファラデーの電気分解の法則2
問題
白金電極を用いて硫酸銅(Ⅱ)CuSO4水溶液を2.0Aの電流で48分15秒間電気分解したとき、陽極に発生する気体の体積(L)として、適切なものは次のうちどれか。
ただし、原子量は、Cu=63.5とし、ファラデー定数は、9.65×104C/molとする。
解 説
流れた電気量を求めます。
=電子の物質量(mol) × ファラデー定数 (C/mol) *
F=9.65 × 104 (C/mol)
C:クーロン
A:アンペア
s:秒
①電気量を、ファラデー定数を使って電子の物質量[mol]に変換する
②電極の半反応式を書き、係数比を使って物質の変化量[mol]を求める
* ファラデー定数は電子1個あたりの電気量の絶対値(電気素量という)eとアボガドロ定数NA(1/mol)の積
NA=6.02 × 1023(1/mol)
e=1.60×10−19(C)
数値計算します。
電気量を$\ce{Q(C)}$で表します。
$\ce{Q(C)=2.0(A) \times (48×60秒+5秒) }$
$ \quad \quad \ce{=2.0 \times 2895}$
$ \quad \quad \ce{=5790(C)}$
ファラデー定数より、電子$\ce{1(mol)}$の電気量は$\ce{96500 (C)}$です。
流れた電子の物質量$x \ce{(mol)}$を求めます。
$\ce{mol}$と$\ce{C}$(クーロン)の比を考えます。
電子$\ce{1mol :96500(C)}$
$x \ \ce{mol :5790 (C)}$
電子$\ce{1mol:96500(C)=}$ $x \ \ce{mol:5790(C)}$
外側同士、内側同士を掛け算して、$x$ molを求めます。
\[ \require{cancel} \begin{align*} x \hspace{3pt} \mathrm{mol} &= \frac{5790 \mathrm{C} }{96500 \mathrm{C} }\times 1 \hspace{3pt}\mathrm{ mol} \\ \\ &= \frac{5790 }{965 \times 10^2 } \\ \\ &=6.0 \times 10^{-2} \quad \mathrm{mol} \end{align*} \]
または
電気量(C)=電流(A) × 時間(s)
=電子の物質量(mol) × ファラデー定数 (C/mol)
より
\[ \begin{align*} \ce{電子の物質量(mol) = \frac{電気量(C)}{ファラデー定数 (C/mol) } } \end{align*} \]
で計算できます。
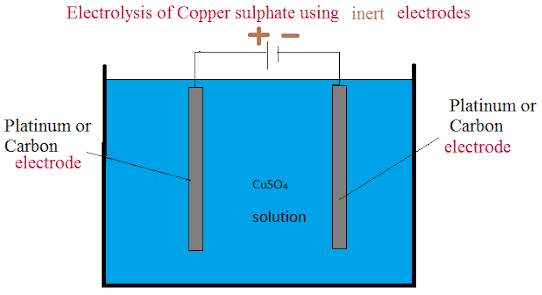
陰極の様子を見ます。
電源の負極から電気分解の対象となる水溶液の陰極に電子が流し込まれます。
しかし、陰極板は電子を受け取る機能を持ち合わせておらず、水溶液中の陽イオンが電子を受け入れることになります。
水溶液中には、銅イオン$\ce{Cu^{2+}}$、水素イオン$\ce{H^+}$が存在しています。
ここで定番のイオン化傾向です。
Li(リッチに) > K(貸そう) > Ca(か) > Na(な) > Mg(ま) > Al(あ) > Zn(あ) > Fe(て) > Ni(に) > Sn(すん) > Pb(な) > (H2)(ひ) > Cu(ど) > Hg(す) > Ag(ぎる) > Pt(借) > Au(金)
$\ce{H}$は、$\ce{Cu}$よりイオン化傾向が大きいです。
$\ce{H}$は、$\ce{Cu}$より陽イオンでいたい。
$\ce{H}$は、$\ce{Cu}$より電子を受け入れにくい。
$\ce{Cu}$は、$\ce{H}$より陽イオンで存在したい意志はありません。
したがって、銅イオン$\ce{Cu^{2+}}$が電子$\ce{2e^{-}}$を受け取り(還元)銅単体になります(析出)。
$\ce{Cu^{2+} + 2e^{-} \longrightarrow Cu}$
陽極の様子を見ます。
電源の正極は、陽極に電子を出してくださいと催促します。
しかし、陽極は正極に電子を提供する能力を持ち合わせておりません。
水溶液中の水が、正極の要求に応じて電子を準備します。
酸化(電子を正極に与える)の半反応式です。
$\ce{2H2O} \longrightarrow \ce{O2 ↑ + 4H^{+} + 4e^{-}}$
陽極では酸素ガスが発生します。
電子$\ce{1(mol)}$に対して酸素分子$\ce{O2}$は$\ce{\frac{1}{4}(mol) }$になっております。
$\ce{O2 (L) = 6.0 \times 10^{-2} \times \frac{1}{4} \times 22.4L }$
$\ce{ =0.336L}$
となります。
電気分解は、外部電源で強制的に酸化還元反応を起こすことです。
電解液と電極の組み合わせを変えることで、さまざまな物質を取り出すことができます。
電解液が硫酸銅(Ⅱ)水溶液の場合、陽極では酸素が発生し、陰極では銅が析出します。
電解液を硫酸銅(Ⅱ)水溶液、陽極を銅板、陰極をステンレス板にすると、陽極の銅板が溶けて銅(Ⅱ)イオンになり、陰極では銅が析出します。
Dokugeki.com hopes you will successfully complete poisonous and deleterious substance handler test.
I would be delighted if this website is helpful for you to obtain the license.
Fortune prefers a person who has prepared minds.
Copyright (C) Since 2015 毒物劇物取扱者.com All Rights Reserved.