毒物劇物取扱者.com
複数条件の場合はキーワードの間にスペースを入れてください。例 特定毒物 劇物
混成軌道
電子の収納数
分子の形や共有結合をよく理解するのに混成軌道はとても有益です。
K殻、L殻、‥、の主殻だけでは結合の説明ができないものが、混成軌道を用いると納得できる分かりやすいものになります。
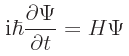
この式はシュレーディンガーの波動方程式と呼ばれるもので、電子の運動を数学的に記述したものです。
この式が殻や結合の根拠になりますが、我々は結果だけを利用させてもらいます。
原子番号1 $\ce{_{1}H }$ 水素のボーア模型を示します。
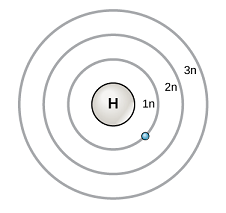
ボーア模型は、電子が原子核から一定の距離の軌道で回ると仮定しました。
\(K\)殻、\(L\)殻、\(M\)殻、\(N\)殻、‥ の概念で説明していました。
波動方程式により、詳しく電子の振る舞いが分かりさらに新しい指標が追加されました。
軌道は3つの量子数で指定される。
①主量子数 \(n:1,2,3,‥\)
②方位量子数\( l:0,1,‥,n-1\)
③磁気量子数\( m_l : -l≦m_l≦l\)
\(n:\)軌道(とエネルギー)の大きさ
\(l\):軌道の形状
\(m_l\):軌道の方向
主量子数\(n\)に数字を入れてみます。
| \(n\) | \(0\) | \(1\) | \(2\) | \(3\) | ‥ |
| 主殻 | \(K\) | \(L\) | \(M\) | \(N\) | ‥ |
方位量子数\(l\)に数字を入れてみます。
| \(l\) | \(0\) | \(1\) | \(2\) | \(3\) | ‥ |
| 副殻 | \(s\) | \(p\) | \(d\) | \(f\) | ‥ |
磁気方位量子数\(m_l\)に数字を入れてみます。
| \(m\) | \(-l≦m_l≦l\) | ||||
| \(0\) | |||||
| \(1\) | \(-1\) | \(0\) | \(1\) | ||
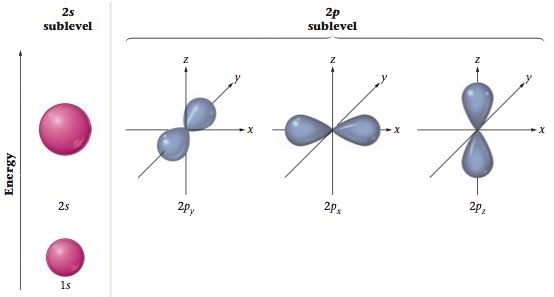
| 軌道 | \(p_x\) | \(p_y\) | \(p_z\) | ||
| 2 | -2 | -1 | 0 | 1 | 2 |
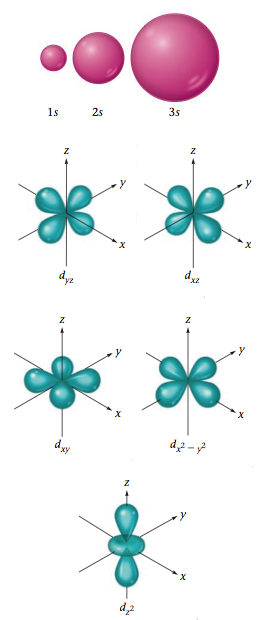
| 軌道 | \(d_{zy}\) | \(d_{xz}\) | \(d_{xy}\) | \(d_{{x^2}-{y^2}}\) | \(d_{z^2}\) |
後に軌道図を示しますのでイメージして頂ければと思います。
電子スピンを考えます。
上向き磁石、下向き磁石のようなもので次の指標を用意します。
スピン磁気量子数\(m_s=+1/2,-1/2\)
パウリの排他原理:つの電子軌道に電子スピンがお互いに逆方向を向いて電子が入る
電子の(エネルギー固有)状態
\(n :1,2,3,‥ ~ ~ \\
\\ m_l: l≦m_l≦l
\\
\\
l:0,1,‥,n-1 \\
\\
m_s:+1/2,-1/2\)
電子は各軌道に最大2個入ることができます。
\(d\)軌道までですがこれを表にまとめます。
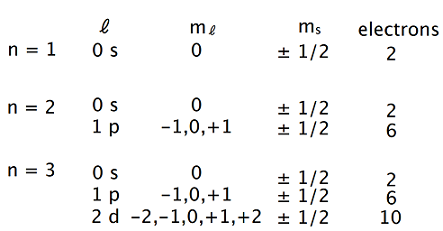
電子を入れた形で典型的な元素を表しました。
記号の意味は以下の通りです。
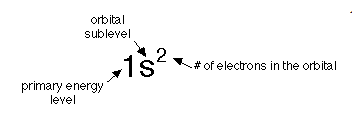
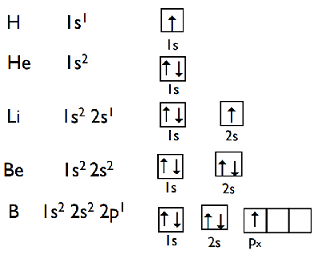
1s2 は、K 殻の s 軌道に電子は2個。
2s1 は、L 殻の s 軌道に電子は1個。
2s2 は、L 殻の s 軌道に電子は2個。
2p1 は、L 殻の p 軌道に電子は1個。
:
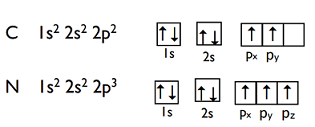
2p3 は、L 殻の p 軌道に電子は3個。
ここで p軌道は3種類ありますので、2p3 は、上の図の N のように 2px、2py、2pzに電子が入りますが、入居順番はフントの規則に従います。
2px に1個 これを ↑で表しておきます。
そして 2py に↑、最後に 2pz に↑と電子が入ります。
フントの規則:エネルギー準位が同じなら電子スピンは平行に入る。
原子番号10のネオン$\ce{_{10}Ne}$は、電子10個で区切りがよいので、10個分を$\ce{Ne}$で表す手法があります。
オクテット則:「第二周期の原子が安定な分子やイオンを形成するとき、最外殻の電子は8個である」
最外殻に電子が8個ある状態は希ガスと同じ電子配置であり、安定であるということから、これを基準にしてみました。
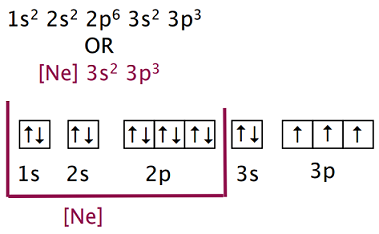
原子番号16の硫黄$\ce{_{16}S}$と原子番号16のマグネシウム$\ce{_{12}Mg}$を、$\ce{Ne}$を用いて表します。

原子番号18のアルゴン$\ce{_{18}A_r}$も用いられます。
電子が各軌道に収容される順番を考えると、\(s\)、\(p\)、\(d\)、\(f\)と素直に入ってくれるのでしょうか。
構成原理:
電子はエネルギーの低い軌道から順に収容される.その順序は\(1s→2s→2p →3s →3p →4s →3d →・・・\)となる。
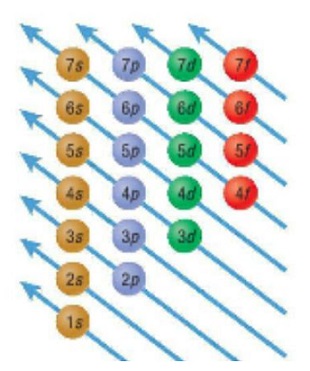
ポイントは、\(→3s →3p →4s\)で\(3p\)から\(3d\)に進と思いきや\(4s\)に進みます。
構成原理の例外の有名な元素をしめします。
半閉殻か閉殻に由来するもの
$\ce{C_r ~ ~ 3d{^5}4s{^1} }$
$\ce{C_u ~ ~ 3d{^10}4s{^1} }$
$\ce{A_g ~ ~ 4d{^10}5s{^1} }$
$\ce{A_u ~ ~ 5d{^10}6s{^1} }$
\(4d\)と\(5s\)、\(5d\)と\(6s\)、\(5d\)と\(4f\)、\(6d\)と\(5f\)のよく似た軌道エネルギーに主な原因があるもの(内部電子間の反発)
$\ce{P_t ~ ~ 4f{^14}5d{^9}6s{^1} }$
$\ce{ {_24}C_r [Ar]~ ~ 4s^{2} 3d^{4} } $予想
\(~ ~ ~ 4s^{1} 3d^{5}\) 現実
\(3d\)より\(4s\)のエネルギー準位が低いため。
\(3d\)軌道は、5個の電子がゆったり個室に入れます。
K殻、L殻の図を示します。
M殻の3d軌道の図を示します。
これで共有結合を説明する準備が大方そろいました。
Dokugeki.com hopes you will successfully complete poisonous and deleterious substance handler test.
I would be delighted if this website is helpful for you to obtain the license.
Fortune prefers a person who has prepared minds.
Copyright (C) Since 2015 毒物劇物取扱者.com All Rights Reserved.
Today Yesterday
Total