毒劇ドットコム
毒物劇物取扱者.com
複数条件の場合はキーワードの間にスペースを入れてください。例 特定毒物 劇物
溶解と溶解度(4問)
毒物劇物取扱者試験は、基本的問題のみが出題されまのでサクサク解ける問題が多いです。
あまり凝った問題は出ませんので確実に得点していくことを願っています。
溶媒を基準とした溶解度の関係なのか、溶液を基準とした溶解度の関係なのか混乱しないようにしましょう。
問題01
70℃のホウ酸の飽和水溶液360gを10℃に冷却したとき、析出するホウ酸の質量(g)として適切なものは次のうちどれか。ただし、70℃のホウ酸の溶解度(水100gに溶けるg数)は、20とし、10℃のホウ酸の溶解度(水100gに溶けるg数)は、5とする。
解 説
溶液、溶質、溶媒を整理しながら組み立てます。
飽和状態であれば水の量に関係なく濃度が同じですから濃度計算を行います。
飽和水溶液$360[g]$の基準で求める溶質・ホウ酸$\ce{H3BO3}$の質量を$ x[g] $とします。
溶解度を考えた場合は、飽和状態で溶質は$100g$が定義です。
溶液は、溶媒(水)と溶質を加算したものです。
溶質と溶液を使う濃度の関係式を立てます。
$70℃$のホウ酸の溶解度$S$(水100$g$に溶ける$g$数)は、$20$です。
$70℃$のホウ酸飽和溶液は$100+20=120$です。
$70℃$のホウ酸飽和溶液$360g$中の溶質を求めます。
\[ \require{cancel} % cancel.js を起動させる \begin{align*} \frac{溶質[g]}{溶液[g]} &= \frac{S}{100+S} \\ \frac{x}{360[g]} &= \frac{ 20 }{ 100+20 } \\ x &= \frac{ 20 }{ \cancel { 120 } } \times \bcancel{ 360 } \\ &= 20 \times 3 \\ &= 60[g] \end{align*} \]
ゆえに、$70℃$のホウ酸飽和水溶液$360g$には、ホウ酸$60g$が水$300g$に溶けていることになります。
この時の溶液が$360[g]$、溶質が$60[g]$そして溶媒(水)が$300[g]$です。
$70℃$時の溶媒$300[g]$が得られましたので、$10℃$の溶媒と比較することができるようになりました。
$10℃$に冷却すると水$100g$にホウ酸は$5g$溶けるから、上で求めた溶媒・水$300g$では溶媒・水$100g$のときの三倍すなわち、$15g$のホウ酸が溶けます。
溶媒・水$300g$基準で統一したことで、析出するホウ酸の重さは$60-15=45g$となります。
すなわち、溶媒・水$300g$基準での溶解度の差$60-15=45g$が温度差における析出となります。
参考までに細かいデータを示しておきます。
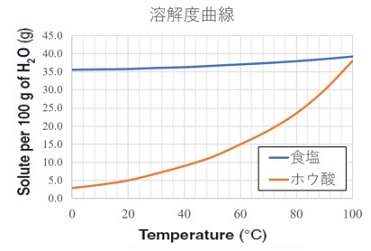
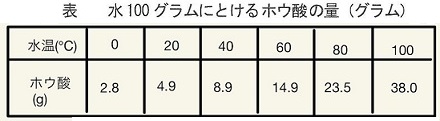
与えられた問題では、”$70℃$のホウ酸の溶解度(水$100g$に溶ける$g$数)は、$20$とし、$10℃$のホウ酸の溶解度(水100$g$に溶ける$g$数)は、$5$とする”として計算しやすいよう数値に設定してあります。
上では結構細かく述べましたので、要点を表と図にしました。
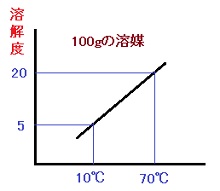
| 溶媒 | 100gモデル | 実際300g |
| 溶解 | 70℃→20g | 60g |
| 10℃→ 5g | 15g | |
| 析出量 | 20-5=15g | 60-15=45g |
問題02
硝酸カリウム96gを80℃を保った水150gに全量溶かし、水溶液を得た。この水溶液をゆっくり冷却していくと結晶が析出し始めた。このときの水溶液の温度に最も近いものはどれか。ただし、硝酸カリウムの 水に対する溶解度(水100gに溶けるg数)は表のとおりとする。
| 温度℃ | 0 | 20 | 40 | 60 | 80 |
| 溶解度 (水100gに溶けるg数) |
13.3 | 31.6 | 63.9 | 109 | 169 |
解 説
硝酸カリウム$\ce{KNO3}$の溶解度$S$が与えられています。
硝酸カリウム$96g$を$80℃$を保った水$150g$に全量溶かし、水溶液を得たそうです。
与えられたデータを利用するため水$100g$のとき硝酸カリウムは何$g$だったのか換算する必要があります。
水$100g$に対する硝酸カリウムを$x[g]$とします。
比の関係を利用します。
\[ \begin{align*} \overbrace {96:150}^{ \color{red}{\boldsymbol{与えられた硝酸カリウムと水} } } &= \overbrace {x : 100}^{ \color{blue}{\boldsymbol{水100g換算した硝酸カリウムx} } } \\ 150 \times x &=96 \times 100 \\ x &= \frac{ 96 }{ 150 } \times 100 \\ &= 64[g] \end{align*} \]
硝酸カリウム飽和水溶液は$80℃$においては溶解度$S$は$169$です。
しかし、与えられた硝酸カリウムと水での溶液は、飽和していません。
ところが冷却していくと溶解度が低下します。
硝酸カリウムの溶解度は、$40℃$においては$63.9$です。
これは$40℃$では$63.9g$で飽和水溶液になることを意味します。
与えられた硝酸カリウムの水$100g$換算は、$64g$ですから$40℃$あたりからもう溶けることができなくなり固体として析出することになります。
参考までにデータを示しておきます。
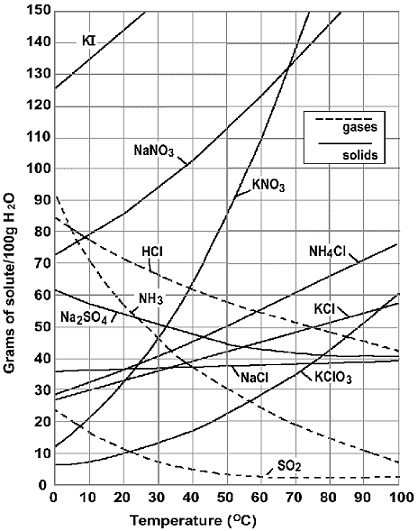
代表的な物質の溶解度です。
硝酸カリウム$\ce{KNO3}$の曲線は縦軸に対して描ききれていません。
問題03
80℃の硝酸カリウム飽和水溶液100gを20℃まで冷却したときに析出する結晶(硝酸カリウム)は何gか。その解答として適切なものは次のうちどれか。ただし、硝酸カリウムの溶解度は20℃で30、80℃で160とする。
解 説
"$80℃$の硝酸カリウム飽和水溶液$100g$"という条件が与えられています。
温度変化による溶解度を考えるうえで溶媒$100g$が基準ですので、このモデルの飽和溶液を想定します。
題意の条件により硝酸カリウム$\ce{KNO3}$の溶解度は$80℃$で$160$ですから、図の上の容器にその情報を書き込みます。
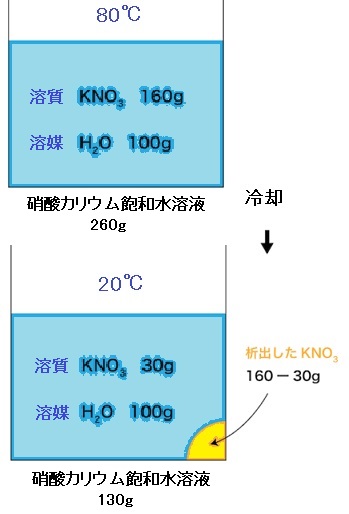
この状態で$20℃$まで冷却すると$20℃$での溶解度は$30$であり、$30g$しか溶けることができないため、もともと溶けていた$160g$の硝酸カリウムのうち$130(=160-30)g$、すなわち溶解度の差が固体として析出します(黄色い所)。
この時の条件は、$80℃$での前提で溶媒・水100$g$、溶質$160g$、(水)溶液$260(=100+160)g$です。
ここで見逃していけないのは、$80℃$基準からみた$20℃$という温度変位の間での析出を$80℃$基準で表しています。
これでお膳立てができました。
問題の要求は、$80℃$の硝酸カリウム飽和水溶液$100g$を$20℃$まで冷却したときに析出する結晶(硝酸カリウム)は何$g$か。
問いかけは、先ほどまで水溶液が$260g$だったものが$100g$水溶液が基準になっています。
”$80℃$であるという温度に関する条件が変わらなければ溶解度は変わらないので、溶液と析出量の比も変化しない”が重要ポイントとなります。
したがって、先ほど求めた溶液$(160+100)$と析出量$(160-30)$の比「$(160+100):(160-30)$」と、 問題が要求している条件での溶液と析出量の比「100:$x$(析出量は$x$とした)」をイコールで結んで、それを比を取って解くことにします。
この時の注意点は、$20℃$での前提で溶媒・水100$g$、溶質$30g$、(水)溶液$130(=100+30)g$を間違えて参照指定はいけません。
上の図で二つのビーカーを比較して式を立てたくなりますが、あくまでも析出の$80℃$換算のための図です。
\begin{align*} 溶液:析出量 &= (100+160):(160-30)=100:x \\ x &= \frac{ \cancel{130} }{ \cancel{ 260 }} \times 100 \\ &= \frac{ 100 }{ 2 } \\ &= 50[g] \end{align*}
これが、80℃の硝酸カリウム飽和水溶液100gを20℃まで冷却したときに析出する結晶(硝酸カリウム)の量です。
類題
60℃のホウ酸の飽和溶液100gを20℃に冷却すると何gのホウ酸が析出するか。ただし、60℃のホウ酸の溶解度(水100gに溶けるg数)は、15とし、15℃のホウ酸の溶解度(水100gに溶けるg数)は、5とする。
解答
基準モデルでの$60℃$の飽和溶液$(100+15)[g]$を$20℃$に冷却すると、溶解度の差$(15-5)[g]$の溶質が析出します。
したがって、換算するために、$100g$の飽和溶液から析出する結晶を$x[g]$とおくと、同一温度では溶液比を計算できます。
\begin{align*} \frac{ 析出量 }{ 溶液 } &= \frac{15-5}{100+15} = \frac{ x }{ 100 } \\ x&=\frac{10}{115} \times 100 \\ &= 8.69 \\ & \risingdotseq{8.7[g]} \end{align*}
溶媒$100g$基準モデルでは、析出量が$10g$ですが、溶液$100g$では析出量も$8.7g$と少し少なくなっています。
ちなみに問題1を上の公式みたいなもので解くと次のようになります。
\begin{align*} \frac{ 析出量 }{ 溶液 } &= \frac{20-5}{100+20} = \frac{ x }{ 360 } \\ x&=\frac{15}{120} \times 360 \\ &= 45 \\ \end{align*}
当然ですが同じ結果となりました。
ちなみに問題3を公式みたいなもので解くと次のようになります。
\begin{align*} \frac{ 析出量 }{ 溶液 } &= \frac{160-30}{100+160} = \frac{ x }{ 100 } \\ x&=\frac{130}{260} \times 100 \\ &= 50 \\ \end{align*}
当然ですが同じ結果となりました。
問題04
40℃の硝酸カリウム飽和水溶液120gの温度を60℃まで上げるとあと何gの硝酸カリウム$\ce{KNO3}$が溶解できるか。その解答として適切なものは次のうちどれか。ただし、硝酸カリウムの溶解度は40℃で60、60℃で110とする。
解 説
固体の溶解度は水$100[g]$あたりで溶質(無水物)が何$g$溶けうるかを数値で表したものです。
したがって、溶媒(水)の量が分かれば、比例計算で何$g$の溶質が溶解するか、析出するかが計算出ます。
何℃基準の時の溶質、溶媒、溶液であるかを見失わないようにしましょう。
溶解度は温度指定でとにかく$100[g]$基準で語られます。
$40℃$基準の溶解度は$60$で$100[g]$基準で与えられています。
問題では、飽和溶液$120g$が指定されていますので、$100[g]$から$120g$換算しなければなりません。
$40℃$の飽和溶液$120g$に溶質$\ce{KNO3}$を$x[g]$含むとして、
\[ \begin{align*} \frac{溶質[g]}{溶液[g]} & = \frac{60}{100+60} = \frac{x}{120} \\ x &= \frac{ 60 }{160 } \times 120 \\ &= \frac{ 60 }{ 4 } \times 3 \\ &= 45[g] \end{align*} \]
溶液$120g$の$45[g]$が溶質$\ce{KNO3}$であることがわかりました。
溶媒(水)は $120-45 = 75[g]$となります。
$60℃$の場合の溶解度を考えたいのですが、溶媒・水は$100[g]$基準でなければなりません。
しかし、上の計算から水は $75[g]$しかありませんので、溶解度も$ 75% $で考えます。
$60℃$の水$75[g]$には、
\[ \begin{align*} 110 \times \frac{ 75 }{100 } = 82.5[g] \end{align*} \]
の溶質が溶けます
溶質$\ce{KNO3}$は$40℃$時点で$45[g]$溶けていますが、温度上昇で$82.5[g]$溶けるようになりましたので、差し引き、あと、$82.5-45=37.5[g]$溶けます。
上では結構細かく述べましたので、要点を表と図にしました。
| 溶媒 | 100gモデル | 実際75g |
| 溶解 | 60℃→110g | 82.5g |
| 40℃→ 60g | 45g | |
| まだ溶ける量 | 110-60=50g | 82.5-45=37.5g |
実際の溶媒が100gモデルの75%ですから、モデルの溶ける量を75%しても簡単に解けます。
冷却すれば析出量、温めればさらに解ける量の問題になっています。
以上
Dokugeki.com hopes you will successfully complete poisonous and deleterious substance handler test.
I would be delighted if this website is helpful for you to obtain the license.
Fortune prefers a person who has prepared minds.
Copyright (C) Since 2015 毒物劇物取扱者.com All Rights Reserved.