毒物劇物取扱者.com
複数条件の場合はキーワードの間にスペースを入れてください。例 特定毒物 劇物
三重結合
1 一酸化炭素 $\ce{CO}$
一酸化炭素 $\ce{CO}$の立体動画 青:$\ce{C}$、赤:$\ce{O}$
上の動画のように一酸化炭素 $\ce{CO}$の形は”直線形”です。
$\ce{_{6}C}$ は 14 族で原子番号が 6です。
$\ce{_{8}O}$ は 16 族で原子番号が 8です。
電子配置は次のように表されます。
$\ce{_{6}C}$ 1s ↑↓ 2s↑↓ 2px↑↓ 2py↑↓ 2pz↑↓lone pair
$\ce{_{8}O}$ 1s ↑↓ 2s↑↓ 2px↑↓ 2py↑↓ 2pz↑↓
$\ce{_{6}C}$と$\ce{_{8}O}$でそれぞれ 2sと2pxの混成軌道を作ります。
$\ce{_{6}C}$ 1s ↑↓ 2sp↑↓ 2sp↑↓ 2py↑↓ 2pz↑↓lone pair
$\ce{_{8}O}$ 1s ↑↓ 2sp↑↓ 2sp↑↓ 2py↑↓ 2pz↑↓
$\ce{_{6}C}$および$\ce{_{8}O}$の電子1個の2ps軌道同士が共有結合します。
この結合は、それぞれの原子核を結ぶ直線状の結合なのでσ結合となります。
さらに電子1個の2py軌道同士が共有結合します。
$\ce{_{6}C}$ 1s ↑↓ 2sp↑↓ 2sp↑↓ 2py↑↓ 2pz↑↓lone pair
$\ce{_{8}O}$ 1s ↑↓ 2sp↑↓ 2sp↑↓ 2py↑↓ 2pz↑↓
この結合は、x 軸に対して垂直方向になりますからπ結合となります。
すると$\ce{_{6}C}$は、電子数を8個の形を形成したがりますから、$\ce{_{8}O}$の2pzから電子1個をもらい、$\ce{_{6}C}$のローンペアの部屋に入れます。
$\ce{_{6}C}$ 1s ↑↓ 2sp↑↓ 2sp↑↓ 2py↑↓ 2pz↑↓
$\ce{_{8}O}$ 1s ↑↓ 2sp↑↓ 2sp↑↓ 2py↑↓ 2pz↑↓
ルイス構造式的には次のように描くこともあります。
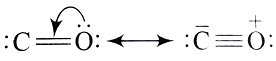
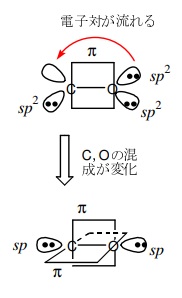
すると、電子1個の2pz 軌道同士が共有結合します。
この結合も、x 軸に対して垂直方向になりますからπ結合となります。
$\ce{_{6}C}$と$\ce{_{8}O}$の三重結合は、σ結合一つとπ結合2つの共有結合となっています。
非共有電子対は $\ce{_{8}O}$ に一つ、$\ce{_{6}C}$ に一つに分かれています。
.$\ce{_{8}O}$ から $\ce{_{6}C}$ へ電子が流れるので、Cδ-Oδ+のように分極しますが、$\ce{_{8}O}$ 原子の大きな電気陰性度のため、もう一つのπ電子とσ電子が大きく $\ce{_{8}O}$ 側に偏るため相殺されてかつわずかに $\ce{_{8}O}$ 側に電子が多くなります。
2 窒素分子 $\ce{N_2}$
窒素分子 $\ce{N_2}$の立体動画 青:$\ce{N}$
上の動画のように窒素分子 $\ce{N_2}$の形は”直線形”です。
ルイス構造式を示します。
![]()
$\ce{_{7}N}$ は 15 族で原子番号が 7です。
$\ce{_{7}N}$ 1つの分子の電子配置は次のように表されます。
$\ce{_{7}N}$ 1s ↑↓ L殻 2s↑↓ 2px↑↓ 2py↑↓ 2pz↑↓
ここで 3 つの 2p 軌道に分散した電子が 3 個ありますが、これだけでは共有結合をつくることがでできません。
共有結合によって原子どうしを結ぶためには、s 軌道が必要です。
何らかのかたちで 2s 軌道を結合に参加させてやる必要があります。
そこで混成軌道の考え方を用います。
すなわち、2s軌道に 2px 軌道を加えて 2sp 混成軌道とします。
繰り返しになりますが 混成軌道 2sp の意味は 2はL殻、s軌道1つとp軌道1つを混ぜたエネルギー的に等価な軌道で軌道数は混合前の数と変わりません。
$\ce{_{7}N}$ 1s ↑↓ L殻 2sp↑↓ 2sp↑↓ 2py↑↓ 2pz↑↓
オクテット則:原子の最外殻電子の数が8個あると化合物やイオンが安定に存在するという経験則。八隅説(はちぐうせつ)ともいう。
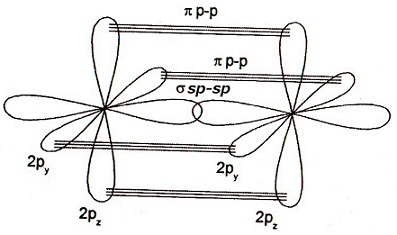
それぞれの$\ce{_{7}N}$にある2sp、2py、2pz同士が共有結合すればL殻がオクテット則を満たし安定します。
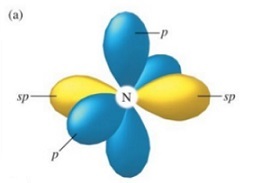
上の図は、$\ce{_{7}N}$ 単体の軌道を描いた鋳物で 2sp、2p の2を省略して sp、p と表しています。
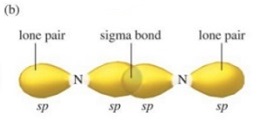
上の図は、2つの $\ce{_{7}N}$ がsp軌道同士で共有結合したσ結合を表しています。
L殻 2sp↑↓がlone pair 孤立電子対を表しています。

上の図は、2つの $\ce{_{7}N}$ が y と z 軸方向の p 軌道同士で共有結合したπ結合 2つを表しています。
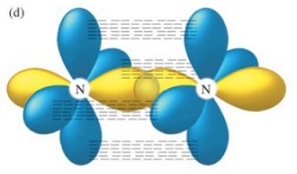
上の図は、2つの $\ce{_{7}N}$ がsp軌道同士で共有結合したσ結合と y と z 軸方向の p 軌道同士で共有結合したπ結合 2つ、合計で 3 つの結合の三重結合を表しています。
別の図を示します。
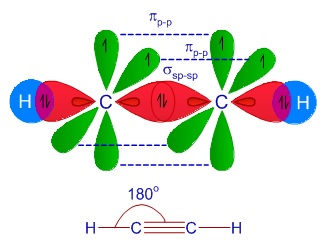
3 アセチレン $\ce{C_{2}H_{2}}$
アセチレン $\ce{C_{2}H_{2}}$の立体動画 青:$\ce{C}$ 白:$\ce{H}$
不飽和炭化水素は、二重結合1つのアルケンと三重結合1つのアルキンがありますが、アルキンの代表例としてアセチレンを取り上げます。
$\ce{C_{2}H_{2}}$ のイメージを示します。
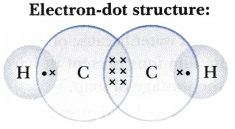
![]()
$\ce{_{6}C}$ は 14 族で原子番号が 6です。
$\ce{_{6}C}$ 1つの分子の電子配置は次のように表されます。
$\ce{_{6}C}$ 1s ↑↓ 2s2 ↑↓ 2px↑↑ 2py↑↑ 2pz↑↓
$\ce{_{1}H}$ 1s ↑↓
炭素原子には、4つの結合(1つは水素、3つは他の炭素)を形成するのに十分な不対電子がないため、2s2ペアの1つを空の2pz軌道に昇位(励起)させる必要があります。
これは、炭素が結合を形成するたびに発生するものとまったく同じ方法です。
$\ce{_{6}C}$ 1s ↑↓ 2s ↑↓ 2px↑↑ 2py↑↑ 2pz↑↑
$\ce{_{1}H}$ 1s ↑↓
共有結合によって原子どうしを結ぶためには、s 軌道が必要です。
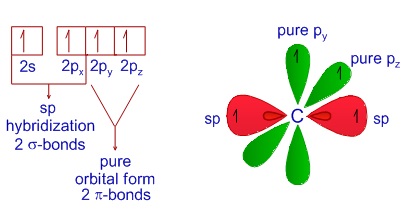
すなわち、2s軌道に 2px軌道を加えて 2sp 混成軌道とします。
$\ce{_{6}C}$ 1s ↑↓ L殻 2sp↑↓ 2sp↑↓ 2py↑↓ 2pz↑↓
$\ce{_{1}H}$ 1s ↑↓
それぞれの$\ce{_{6}C}$にある1つの2sp、2py、2pz同士が共有結合し、残りの 2sp が$\ce{_{1}H}$と結合すればL殻がオクテット則を満たし安定します。
図形でまとめると次に様になります。
問題
分子内の共有電子対と非共有電子対の数が等しい分子として適切なものは次のうちどれか。
選択肢(2)が適切です。
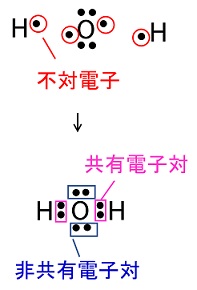
共有電子対………2組
非共有電子対……2組
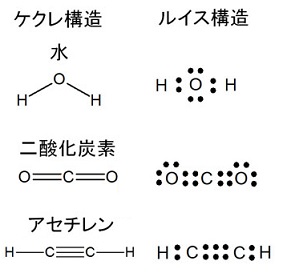
窒素N2の電子式
![]()
共有電子対………1組(三重結合)
非共有電子対……2組
したがってこれは、不適切です。
窒素分子N2は、窒素原子どうしが三重結合しています。
ちなみにアセチレンの共有電子対は5組、非共有電子対はなし。
Dokugeki.com hopes you will successfully complete poisonous and deleterious substance handler test.
I would be delighted if this website is helpful for you to obtain the license.
Fortune prefers a person who has prepared minds.
Copyright (C) Since 2015 毒物劇物取扱者.com All Rights Reserved.
Today Yesterday
Total