毒劇ドットコム
毒物劇物取扱者.com
複数条件の場合はキーワードの間にスペースを入れてください。例 特定毒物 劇物
毒物劇物取扱者試験問題
演習No.005
問題20
化学反応を表したものとして、適切なものは次のうちどれか。
解 説
選択肢(1)が適切です。
与えられた問題は、水素Hの数を左右で等しいものを見つけると選択肢(1)であることが分かります。
左辺:2×4+2=10
右辺:2×3+2×2=10
実験室では、塩化アンモニウムNH4Clと水酸化カルシウムCa(OH)2の混合物を加熱し、上方置換で捕集します。
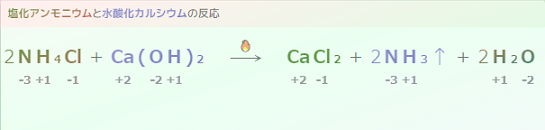
2NH4Cl+Ca(OH)2→CaCl2+2NH3↑+2H2O
この反応は、強塩基Ca(OH)2により弱塩基NH3を追い出す反応のひとつです。
弱塩基のイオンのNH4+が強塩基からOH-を受け取り、弱塩基のNH3にもどっていくのが主反応です。

化学反応式の作り方
①反応物を左辺に、生成物を右辺にそれぞれ化学式を書き、両辺を→でむすびます。
②両辺の各原子の数が等しくなるように、化学式の前に係数を付けます。
係数は最も簡単な整数比とします。
係数の1は省略します。
③変化しなかった溶媒や溶液は、反応式の中には書きません。
目算法
最も複雑そうな(多種類の原子を含む)物質の係数を1とおき、他の物質の係数を暗算で決めます。
係数が分数になれば、分母をはらって整数にします。
さて、この化学反応式は高校化学では有名人物のようです。
当Website管理人は、なんのこっちゃと全然わかりませんでした。
まず、アンモニアの特徴。
・刺激臭がある
・1価の弱塩基である
・水に溶けやすい
塩化水素とアンモニアを接触させると、塩化アンモニウム$\ce{NH4Cl}$の白煙が生じます。
$\quad \ce{HCl + NH3 \longrightarrow NH4Cl}$
この反応は$\ce{HCl}$、$\ce{NH3}$ それぞれの検出に利用されます。
塩化アンモニウム$\ce{NH4Cl}$は、強酸$\ce{HCl}$と弱塩基$\ce{NH3}$による正塩です。
正塩とは、酸の$\ce{H}$も塩基の$\ce{OH}$も残っていない塩のことです。
塩 + 塩基 → 塩 + 水 (中和反応)
弱塩基遊離反応というものがあります。
弱塩基を含む塩 + 強塩基 → 強塩基を含む塩 + 弱塩基
弱塩基からなる塩と強塩基を混ぜ合わせると、弱塩基が生じます。
これを弱塩基遊離反応といいます。
試験管の中に、塩化アンモニウム$\ce{NH4Cl}$ と 水酸化カルシウム$\ce{Ca(OH)2}$ の2種類の固体を混ぜて入れます。
そして、この混合物をガスバーナーで加熱します。
この弱塩基からなる塩に強塩基を加えることで、弱塩基の遊離が起こっているわけです。
塩化アンモニウム$\ce{NH4Cl}$は、電離してアンモニウムイオン$\ce{NH4^+}$を生じます。
$\quad \ce{NH4Cl \longrightarrow NH4^{+} + Cl^-}$
ここに、水酸化カルシウムのような強塩基を加えると、弱塩基由来のイオンと強塩基から電離した$\ce{OH^-}$がくっつき、 弱塩基であるアンモニア$\ce{NH3}$ができます。(弱塩基はくっつきやすいため)
$\quad \ce{2NH4Cl + Ca(OH)2 \longrightarrow 2NH3 + CaCl2 + 2H2O}$
($\quad \ce{ NH4^+ + OH^{-} \longrightarrow NH3 + H2O }$)
弱塩基遊離反応
弱塩基を含む塩である塩化アンモニウム$\ce{NH4Cl}$と強塩基である$\ce{Ca(OH)2}$を反応させると【アンモニア$\ce{NH3}$】が遊離する。
この式は、炭酸ナトリウム$\ce{Na2CO3}$のアンモニアソーダ法(ソルベー法)で、アンモニアを生成させる式として登場します。
それでこの式は有名ということらしいです。
この反応は、酸化数の増減がありませんので、酸化還元反応ではありません。
ちなみに、酸・塩基反応というそうです。
- 【性状】
無色透明、揮発性の液体。
鼻をさすような臭気。
アルカリ性。
水と混和する。
- 【用途】
化学工業用、医薬用ほか、試薬。
- 【応急】
漏えいした液は土砂等でその流れを止め、、遠くから多量の水を用いて十分に希釈して洗い流す。
- 【注意】
アンモニア水は温度の上昇により空気より軽いアンモニアガスを生成する。
- 【鑑識】
強い臭気でわかるが、濃塩酸を潤したガラス棒を近づけると、白い霧を生じる。
また、塩酸を加えて中和した後、塩化白金液を加えると、黄色、結晶性の沈殿が生じる。
- 【貯蔵】
揮発しやすいので、密栓して保管する。
Dokugeki.com hopes you will successfully complete poisonous and deleterious substance handler test.
I would be delighted if this website is helpful for you to obtain the license.
Fortune prefers a person who has prepared minds.
Copyright (C) Since 2015 毒物劇物取扱者.com All Rights Reserved.