毒劇ドットコム
毒物劇物取扱者.com
複数条件の場合はキーワードの間にスペースを入れてください。例 特定毒物 劇物
毒物劇物取扱者試験問題
演習No.006
問題 16
解 説
今回は、中和滴定という実験に関する問題です。
- 出題のねらい:
弱酸と強塩基の中和滴定における指示薬の選択
この問題は、次の2つの重要な化学の知識を理解しているかを確認するためのものです。
- 中和反応のゴール(終点)の液性:
弱い酸と強い塩基を反応させたとき、ちょうど中和が終わる瞬間の溶液が、酸性・中性・塩基性のうち、どれになるか。 - 指示薬の選択:
中和のゴール(終点)の液性に合わせて、色の変わる範囲(変色域)が適切な指示薬を選べるか。
化学のABC:
酸・塩基・中和とは?
- 酸:
水に溶けて $\text{H}^+$(水素イオン)を出す物質。例:酢酸。 - 塩基:
水に溶けて $\text{OH}^-$(水酸化物イオン)を出す物質。例:水酸化ナトリウム。 - 中和:
酸と塩基を混ぜて、お互いの性質を打ち消し合う反応。$\text{H}^+$ と $\text{OH}^-$ がくっついて水 ($\text{H}_2\text{O}$) ができるのが中和です。
ステップ 1:
中和滴定のゴール(終点)の液性を判断する
今回の実験で混ぜる物質は次の通りです。
| 物質 | 分類 | 性質の強さ |
| 酢酸 ($\text{CH}_3\text{COOH}$) | 酸 | 弱酸 (弱い酸) |
| 水酸化ナトリウム ($\text{NaOH}$) | 塩基 | 強塩基 (強い塩基) |
終点の液性はどうなる?
- 強酸と強塩基を中和した場合、ゴールは中性 ($\text{pH} \approx 7$) になります。
- 弱酸と強塩基を中和した場合、できた塩(えん)が水に溶けて加水分解(かすいぶんかい)という現象を起こし、わずかに $\text{OH}^-$ が増えるため、ゴールは塩基性(アルカリ性)に傾きます($\text{pH} > 7$)。
今回は「弱酸(酢酸)」と「強塩基(水酸化ナトリウム:苛性ソーダ)」の組み合わせなので、中和がちょうど終わった瞬間(終点)の溶液は塩基性($\text{pH} \approx 8 \sim 9$)になります。
ステップ 2:
指示薬の選択と色の変化
中和滴定で使う指示薬は、終点の液性(今回は塩基性)の範囲で色が大きく変わるものを選ばなければなりません。
| 指示薬の名前 | 強い酸性 (pH<3) | 弱い酸性~中性 | 弱い塩基性 (pH>8) | 変色域 (色が変わり始める$\text{pH}$の範囲) | 適切な中和反応 |
| メチルオレンジ (MO) | 赤色 | 橙色 | 黄色 | $3.1 \sim 4.4$ ($\text{pH} \approx 4$) | 強酸と強塩基の滴定、強酸と弱塩基の滴定 |
| フェノールフタレイン (PP) | 無色 | 無色 | 赤色 | $8.0 \sim 9.8$ ($\text{pH} \approx 9$) | 強酸と強塩基の滴定、弱酸と強塩基の滴定 |
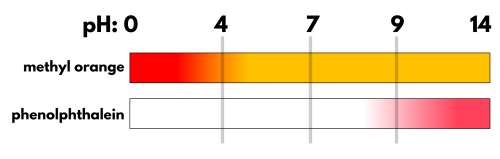
適切な指示薬は?
今回の終点は塩基性($\text{pH} \approx 8 \sim 9$)です。
- メチルオレンジ:
変色域が $\text{pH} 3.1 \sim 4.4$ で、酸性側で色が変化してしまいます。中和のゴール($\text{pH} 8 \sim 9$)とはかけ離れているため、不適切です。 - フェノールフタレイン:
変色域が $\text{pH} 8.0 \sim 9.8$ で、終点の塩基性にぴったり合っています。ごくわずかに $\text{NaOH}$ を加えすぎた瞬間に、無色から赤色へ鮮やかに変化し、正確に終点を知ることができます。適切です。
今回の反応(弱酸 $\rightarrow$ 強塩基で滴定)に適した指示薬はフェノールフタレインです。
(1) メチルオレンジ ―――― 赤色から黄色へ
選択肢 (1)は不適切です。
- 指示薬の不適切さ:メチルオレンジの変色域 ($\text{pH} 3.1 \sim 4.4$) は、今回の終点 ($\text{pH} 8 \sim 9$) よりも大きく酸性に偏っています。中和がちょうど終わる前に色が変わり始めてしまうため、正確な中和点を測定できません。
(2) メチルオレンジ ―――― 無色から赤色へ
選択肢 (2)は不適切です。
- 指示薬の不適切さ:
メチルオレンジは酸性で赤色、塩基性で黄色に変化します 。この選択肢の色変化(無色→赤色)は、メチルオレンジの正しい色の変化ではありません。
(3) フェノールフタレイン ― 赤色から黄色へ
選択肢 (3)は不適切です。
- 指示薬の適切さ:フェノールフタレインは今回の終点に合う適切な指示薬です。
- 色の変化の不適切さ:
フェノールフタレインは酸性・中性で無色、塩基性で赤色に変化します 。赤色から黄色へ変化するという記載は、色の変化として間違いです。
(4) フェノールフタレイン ― 無色から赤色へ
選択肢 (4)は適切です。
- 指示薬の適切さ:フェノールフタレインは、弱酸と強塩基の中和終点である塩基性 ($\text{pH} 8 \sim 9$) で色が変化するため、この実験に最も適した指示薬です。
- 色の変化の適切さ:滴定開始時(酢酸水溶液)は酸性なので無色です。水酸化ナトリウム水溶液を加えて中和が終わり、わずかに塩基性になった瞬間に色が赤色に変化します。この色の変化の記述は正しいです。
まとめ総括
この問題の正解は、選択肢 (4) です。
【この問題の最重要ポイント】
- 弱酸(酢酸)と強塩基($\text{NaOH}$)の中和のゴールは塩基性 ($\text{pH} > 7$) になる!
- 終点が塩基性のときは、塩基性側で色が変化するフェノールフタレイン(変色域 $\text{pH} 8.0 \sim 9.8$)を選ぶのがルール!
- フェノールフタレインは、無色(酸性側) $\rightarrow$ 赤色(塩基性側)に変化します。
指示薬の選び方は、毒物劇物取扱者試験で必ず問われる重要事項です。

問題の意味がいまいち分からなかった場合
まずは「0.1 mol/L の酢酸水溶液 10 mL に 0.1 mol/L の水酸化ナトリウム水溶液を加える」という文章が、何を意味しているのかを解説します。
🧪 そもそも「0.1 mol/L」って何?
これは 濃さ(濃度: 溶質の混み具合) を表す数字です。
- mol(モル) は「粒の数」を表す単位
- L(リットル) は体積の単位
- 0.1 mol/L は
- →「1 L の中に 0.1 mol の物質が溶けている」という意味
つまり、
- 0.1 mol/L の酢酸水溶液 は「ちょうど決まった濃さの酢酸の水溶液」
- 0.1 mol/L の水酸化ナトリウム水溶液 も同じく「決まった濃さの NaOH の水溶液」
🧪 では「10 mL の酢酸水溶液に NaOH を加える」とは?
これは 中和反応をさせるために、酸(酢酸)に塩基(NaOH)を少しずつ加えていく実験 のこと。
- 酢酸($\ce{CH₃COOH}$)…弱い酸
- 水酸化ナトリウム(NaOH)…強い塩基
この2つを混ぜると 中和反応 が起きる。
🧪 中和滴定とは?
酸と塩基を反応させて、
ちょうど中和する点(当量点) を調べる実験。
そのとき、
「色が変わる薬=指示薬(しじやく)」
を使って、中和した瞬間を見つける。
🧪 ここまでをまとめると…
- 酢酸は「すっぱい液」
- 水酸化ナトリウムは「強いアルカリの液」
- どちらも同じ濃さ(0.1 mol/L)
- 酢酸を10 mL 用意して、そこにアルカリを少しずつ入れていく
- 酸とアルカリがちょうど同じ量になると「中和」
- その瞬間を色の変化で見つけるのが「指示薬」
🧪 では、この問題で使う指示薬は?
酢酸(弱酸)+ $\ce{NaOH}$(強塩基)の中和では
フェノールフタレイン が最適。
- 酸性 → 無色
- 中性〜弱塩基性 → ピンク色
だから色の変化は
無色 → ピンク色
それでもやっぱり問題の意味がいまいち分からなかった場合
実は「中和」という言葉が、日常語のイメージと化学の定義でズレているせいで、余計に難しく感じます。
中和とは化学的には、まさに 「酸と塩基のモルが釣り合った点」 を指しているからです。
🔍 では、化学でいう「中和」とは何か?
化学の世界では、中和とは
酸の $\ce{H⁺}$ と 塩基の $\ce{OH⁻}$ が、化学量論的にちょうど等量反応して水になること
を指します。
式で書くと
\[ \mathrm{H^+ + OH^- \rightarrow H_2O} \]
つまり、
$\ce{H⁺}$ と $\ce{OH⁻}$ のモルが等しくなった瞬間が「中和点」。
🧠 ではなぜ「中和」という言葉が使われるのか?
歴史的には
- 酸 → すっぱい
(酢酸、クエン酸、乳酸、リンゴ酸、酒石酸、 …) - 塩基 → 苦い・ぬるぬる
(水酸化ナトリウム、重曹(炭酸水素ナトリウム)、水酸化カリウム、炭酸ナトリウム、…) - 混ぜると「性質が打ち消される」= neutralize(中立化)
という感覚的な言葉から始まっています。
しかし現代化学では、
性質が中性になるかどうかは関係ない のです。
たとえば:
- 強酸 × 強塩基 → 当量点 pH = 7
- 弱酸 × 強塩基 → 当量点 pH > 7
- 強酸 × 弱塩基 → 当量点 pH < 7
つまり、
中和しても pH が中性になるとは限らない。
だから「中和」という言葉は、現代の定義と少しズレている。
🧪 では、現代化学の正確な定義は?
現代化学では、中和は
酸と塩基が化学量論的に等量反応した点(当量点)
を指す。
つまり、
- 酸のモル
- 塩基のモル
が 反応式の比でちょうど一致した瞬間。
繰り返しになりますが、
中和における「当量点(等量点)」とは、酸と塩基が化学量論的に(つまり、反応の化学式に従って)過不足なく完全に反応し合った一点のことで、この点で溶液中には過剰な酸も塩基も残らず、
🌱 まとめると…
- 「中和」という言葉は歴史的な名残で、現代化学の定義とは少しズレている
- 現代化学では $\ce{H⁺}$ と $\ce{OH⁻}$ のモルが等しくなった点 を当量点と呼ぶ
- pH が中性になるかどうかは関係ない
Dokugeki.com hopes you will successfully complete poisonous and deleterious substance handler test.
I would be delighted if this website is helpful for you to obtain the license.
Fortune prefers a person who has prepared minds.
Copyright (C) Since 2015 毒物劇物取扱者.com All Rights Reserved.