毒劇ドットコム
毒物劇物取扱者.com
複数条件の場合はキーワードの間にスペースを入れてください。例 特定毒物 劇物
毒物劇物取扱者試験問題
鉄イオン(Fe2+、Fe3+)の性質
問題
鉄イオン(Fe2+、Fe3+)の性質に関する記述のうち、適切なものは次のうちどれか。
奈良県
解 説
(1)$\ce{Fe^{2+}}$の水溶液は黄褐色、$\ce{Fe^{3+}}$の水溶液は淡緑色である。
選択肢(1)は、不適切です。
正しくは、以下の通りです。
$\ce{Fe^{2+}}$の水溶液は淡緑色、$\ce{Fe^{3+}}$の水溶液は黄褐色である。
(2)$\ce{Fe^{2+}}$、$\ce{Fe^{3+}}$の配位数はいずれも4で、錯イオンは正四面体の構造をとる。
選択肢(2)も、不適切です。
正しくは、以下の通りです。
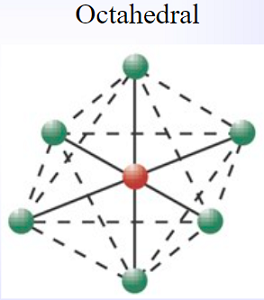
$\ce{Fe^{2+}}$、$\ce{Fe^{3+}}$の配位数はいずれも6で、錯イオンは正八面体の構造をとる。
(3)$\ce{Fe^{2+}}$の水溶液にアンモニア水を加えるとゲル状沈殿を生成するが、この沈殿は過剰のアンモニア水を加えても溶解することはない。
選択肢(3)が適切です。
$\ce{Fe^{2+}}$、$\ce{Fe^{3+}}$をそれぞれ含む水溶液に、$\ce{NaOH}$水溶液またはアンモニア水を加えると、それぞれ緑白色の水酸化鉄(Ⅱ)$\ce{Fe(OH)2}$と赤褐色の水酸鉄(Ⅲ)$\ce{Fe(OH)3}$のゲル状沈殿を生成します。
いずれの水酸化鉄も、過剰の$\ce{NaOH}$水溶液、アンモニア水にも溶解しません。
$\ce{Fe^2+}$、$\ce{Fe^3+}$とも一度沈殿したらそれっきりで沈殿が溶けたりすることはないんです。
$\ce{Fe^2+}$の水溶液は淡い緑色、$\ce{Fe^3+}$の水溶液は黄褐色です。
アンモニア水$\ce{NH3}$は、
$\ce{ NH3 + H2O \rightleftarrows NH^4+ + OH^-}$
により$\ce{OH^-}$を放出。
$\ce{Fe^2+}$は、
$\ce{Fe^2+ + 2OH^- → Fe(OH)2↓}$(淡緑色、緑白色)
$\ce{Fe(OH)2}$(水酸化鉄(Ⅱ))の沈殿は淡緑色もしくは緑白色です。
$\ce{Fe^2+}$は淡緑色なので、それの沈殿になると淡緑色に白色を混ぜた感じの色になるので覚えやすい。
$\ce{Fe^3+}$は、
$\ce{Fe^3+ + 3OH^- → Fe(OH)3↓}$(赤褐色)
(4)$\ce{Fe^{2+}}$を含む水溶液にチオシアン酸カリウム水溶液を加えると血赤色の溶液となる。
選択肢(4)は不適切です。
正しくは、以下の通りです。
$\ce{Fe^{3+}}$を含む水溶液にチオシアン酸カリウム($\ce{KSCN}$)水溶液を加えると血赤色の溶液となる。
$\ce{Fe^{3+} + SCN^- → [FeSCN]^2+}$
赤血色の$\ce{[FeSCN]^2+}$が生じます。
錯イオンなので沈殿しません。
奈良県の問題は難しいですね。
永遠の化学初級レベルの当WebSite管理人には手に負えません。
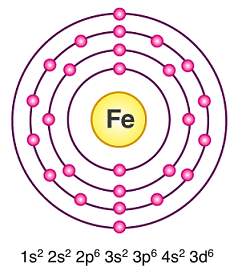
鉄$\ce{_26Fe}$です。
遷移元素です。
1・2属の典型元素から、12属の典型元素へと移り変わる間の元素との意味で「遷移」元素と名付けられたようです。
26個の電子が、s、p、d軌道に配置されます。
s→p→d のように順序良く入ればいいのに、1s2 2s2 2p6 3s2 3p6 4s2 3d6で4s2 3d6が入れ替わっています。
このような配置をするものが遷移元素です。
遷移元素は、
(1)全て金属元素である
(2)全て融点が高い
(3)殆どが重金属であり、密度が高い
(4)最外殻電子は1または2である
(5)酸化数は一定の値ではなく複数
(6)錯イオンをつくる
(7)有色の物質が多い
(8)触媒としてよく用いられる。

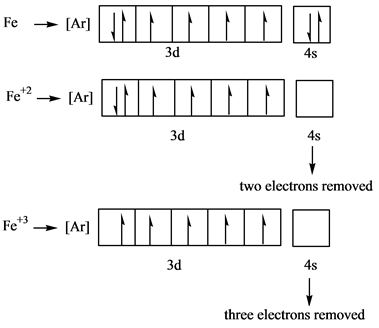
$\ce{Fe(3d^6 , 4s^2)}$では、最外殻の$\ce{4s}$電子が2個放出されると$\ce{Fe^2+}$になり、さらに$\ce{3d}$電子が1個放出されると、$\ce{Fe^3+}$になります。
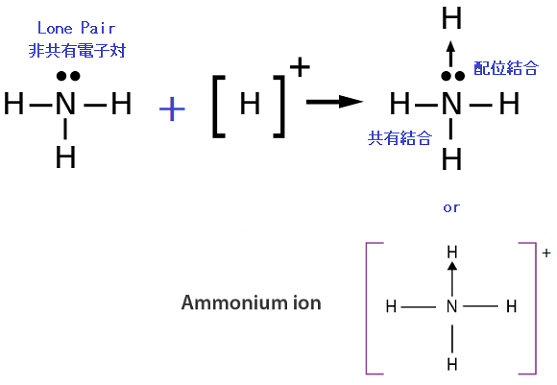
“配位結合(coordinate bond, dative bond)”とは、片方の原子だけが電子対を差し出して作られる結合のことをいいます。
不対電子を1個ずつ出し合う共有結合(covalent bond)に対して、配位結合では片方が2個(非共有電子対 lone pair)、もう片方が0個出し合って結合します。
たとえば、アンモニウムイオン$\ce{NH^{4+}}$では窒素原子の非共有電子対を水素イオンに一方的に供与することで結合が形成されています。
鉄(Ⅲ)イオン$\ce{ Fe^{3+}}$とシアン化物イオン$\ce{CN^{-}}$が反応すると、錯イオンのヘキサシアニド鉄(Ⅲ)酸イオン$ \ce{ [ Fe(CN)_6]^{3−} }$ が生成します。
$\ce{ \underbrace{ Fe^{3+} }_{鉄(Ⅲ)イオン} + 6 \underbrace{CN^{-}}_{シアン化物イオン}→[\underbrace{Fe(CN)_{6}}_{ヘキサシアニド鉄(Ⅲ)酸イオン}]^{3−} }$
酸化数
$\ce{\underbrace{ Fe^{3+} }_{+3} + 6 \underbrace{C}_{+2} \underbrace{N^{-}}_{-3}→[\underbrace{Fe^{3+}}_{+3}(\underbrace{C}_{2+} \underbrace{N}_{-3})_{6}]^{3−} }$
配位結合や水素結合などにより、1つにまとまっている分子のことを錯体といいます。
その中で、錯イオンとは、中心となる金属イオンに、非共有電子対をもつ分子や陰イオンが(配位)結合しているイオンのことをいいます。
錯イオンにおいて、金属イオンに配位結合している分子やイオンのことを配位子といいます。
あるいは、配位子とは、非共有電子対をもち、配位結合している分子や陰イオンのことをいいます。
配位子には、分子や陰イオンがあり、つぎのようなものがあります。
$\ce{H2O}$(アクア)、$\ce{NH3}$(アンミン)、$\ce{OH^-}$(ヒドロキシド)、$\ce{CN^-}$(シアニド)、$\ce{Cl^-}$(クロリド)
配位数:金属イオンに配位する配位子の数を配位数といい、金属イオンの種類にのよりほぼ決まっています。
以下が各金属イオンの配位数です。
| 金属イオン | 配位数 | 形 |
|---|---|---|
| $\ce{Ag^+}$ | 2 | 直線 |
| $\ce{Zn^2+}$ | 4 | 正四面体 |
| $\ce{Cu^2+}$ | 4 | 正方形 |
| $\ce{Al^3+}$ | 6 | 正八面体 |
| $\ce{Fe^2+}$ | 6 | 正八面体 |
| $\ce{Fe^3+}$ | 6 | 正八面体 |
$\ce{ Fe^{3+} + 6CN^{-}→[Fe(CN)_6]^{3−} }$
3価の鉄イオンにシアン化物イオンが6個配位結合しています。
ギリシャ語で6は“ヘキサ”です。
シアン化物イオンは、配位子になると、“シアニド”になります。
注意しなければいけないのは、ヘキサシアニド鉄(Ⅲ)酸イオンにおいては、イオン全体の電荷がマイナスになっている点です。
錯イオン全体の電荷が負になる時、名前に “酸” をつけることになっています。
反応
$\ce{Fe^2+ + KSCN}$⇒変化なし
最初に加えるのは、チオシアン酸カリウム$\ce{KSCN}$です。
とは言っても、$\ce{KSCN}$では変化は起こりません。
次に、ヘキサシアニド鉄(Ⅲ)酸カリウム$\ce{K3[Fe(CN)6]}$ を加えてみましょう。
すると、濃青色沈殿を生じます。
$\ce{Fe^2+ + K3[Fe(CN)6]}$⇒濃青色沈殿
最後に、ヘキサシアニド鉄(Ⅱ)酸カリウム$\ce{K4[Fe(CN)6]}$ を加えると、青白色沈殿が生じます。
$\ce{Fe^2+ + K4[Fe(CN)6]}$⇒青白色沈殿
鉄イオンの構造は、六配位正八面体です。
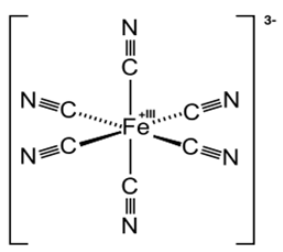
混成軌道を使うとうまいこと理解できるかもしれませんが、試験には名称を思えておけばそれで十分です。
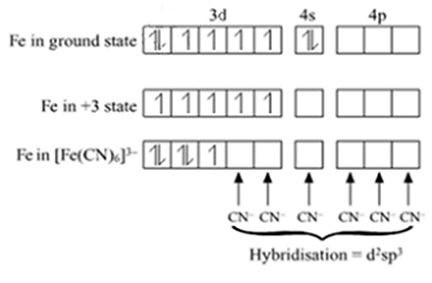
鉄の3d、4s、4pの空席にCNが6個、配位結合しています。
Dokugeki.com hopes you will successfully complete poisonous and deleterious substance handler test.
I would be delighted if this website is helpful for you to obtain the license.
Fortune prefers a person who has prepared minds.
Copyright (C) Since 2015 毒物劇物取扱者.com All Rights Reserved.