毒劇ドットコム
毒物劇物取扱者.com
複数条件の場合はキーワードの間にスペースを入れてください。例 特定毒物 劇物
毒物劇物取扱者試験問題
酸化と還元2
問題
酸化還元反応に関する化学式として、不適切なものは次のうちどれか。
オリジナル
解 説
ぱっと見た感じ、分子単体が存在している式は、酸化還元反応だと思います。
単体がないから
(3)$ \quad \ce{2NaOH + SO2 → Na2SO3 + H2O}$
怪しいので、チェックしてみます。
1.化合物中の酸化数の和は、0である
2.アルカリ金属の酸化数は+1、アルカリ土類金属は+2
3.ハロゲンの酸化数は、原則-1である
4.水素の酸化数は+1
5.酸素の酸化数は、-2である(過酸化水素中の酸素の酸化数は-1とする)
これらに従うと、$\ce{ NaOH}$中の$\ce{Na}$は+1、$\ce{O}$は-2、$\ce{H}$は+1、$\ce{SO2}$は$\ce{O}$は-2なので$\ce{S}$は+4。
$\ce{Na2SO3}$の$\ce{Na}$は+1、$\ce{O}$は-2、$\ce{S}$は、+4とわかります。
左辺 $\ce{SO2}$:+4 + (-2)×2=0
右辺 $\ce{Na2SO3}$:(+1)×2 + 4 + (-2)×3 =0
左辺 $\ce{NaOH}$:+1 + (-2) + 1 =0
右辺 $\ce{H2O}$:(+1)×2 + (-2)=0
原子の酸化数の増減がありませんので、酸化還元反応ではありません。
水酸化ナトリウム$\ce{NaOH}$と二酸化硫黄$\ce{SO2}$が反応すると、亜硫酸ナトリウム$\ce{Na2SO3}$と水$\ce{H2O}$が生成します。
酸化物を一端、水と反応して酸・塩基とする考え方をします。
二酸化硫黄$\ce{SO2}$は非金属の酸化物なので酸性酸化物です。
そのため、水$\ce{H2O}$と反応して生じる物質は当然のこと、酸です。
$ \quad \ce{SO₂ + H₂O→H₂SO₃}$ …(1)
$\ce{H₂SO₃}$は二価の酸なので、一分子の$\ce{H₂SO₃}$から生じる$\ce{H^⁺}$は二つです。
このような中和反応では、$\ce{H^⁺}$と$\ce{OH^⁻}$で水$\ce{H2O}$が生じるので、そうなるように$\ce{NaOH}$を足してあげると、
$ \quad \ce{H₂SO₃ + 2NaOH→Na₂SO₃ + 2H₂O}$ …(2)
となります。
(2)の左辺にある$\ce{H₂SO₃}$は(1)のように$\ce{SO₂}$と$\ce{H₂O}$の反応で生じたものです。
つまり見方を変えると
$ \quad \ce{”H₂ SO₃=SO₂ + H₂ O”}$
となるのでこれを(2)に代入すると
$ \quad \ce{SO₂ + H₂O + 2NaOH→Na₂SO₃ + 2H₂O}$ …(3)
化学反応式では左辺に反応物を右辺に生成物を書きます。
左辺と右辺に同じ物質があるということは反応していないのと扱われるので、(3)の左辺と右辺にある$\ce{H₂O}$を約分のようにすると、
$ \quad \ce{SO₂ + 2NaOH→Na₂SO₃ + H₂O}$
となって題意の反応式ができます。
長くなりました。
(1)$ \quad \ce{2Al + 3H2SO4 → Al2(SO4)3 + 3H2}$
アルミニウム$\ce{Al}$に希硫酸$\ce{H2SO4}$を加えると水素$\ce{H2}$が発生します。
反応前の$\ce{Al}$は単体なので酸化数は0となります。
反応後の$\ce{Al2(SO4)3}$は、$\ce{SO4}$が2価の陰イオンになるので、$\ce{SO4}$の酸化数は-2となります。(イオンは価数が酸化数となります)
化合物全体の酸化数が0となるので$\ce{Al}$の酸化数を$x$とすると、
$x ×2 +(-2)×3 = 0$
となるので、
$x = 6/2 =+3$
となります。
したがって、$\ce{Al}$の酸化数は
$0→+3$
に変化しています。
(2)$ \quad \ce{2KI + Br2 → 2KBr + I2}$
ハロゲンの単体は、他の物質から電子を奪う性質(酸化力)があります。
この酸化力の強さを不等号で表すと、次のようになります。
$ \quad \ce{ F2 > Cl2 > Br2 > I2}$
塩素$\ce{Cl}$と臭素$\ce{Br}$の2つが登場する反応として、次のようなものがあります。
$\quad \ce{ 2KBr + Cl2 → 2KCl + Br2}$
臭素$\ce{Br}$の酸化数は、-1→0と変化し、塩素$\ce{Cl}$の酸化数は、0→-1と変化しています。
塩素$\ce{Cl}$は臭素$\ce{Br}$より酸化力が強いので、酸化剤としてはたらいているわけです。
酸化力の強弱を不等号で表すと、次のようになります。
$\quad \ce{ Cl2 > Br2 }$
次に、臭素$\ce{Br}$とヨウ素$\ce{I}$の関係は次のようになります。
$\quad \ce{ 2KI + Br2 → 2KBr + I2}$
ヨウ素$\ce{I}$の酸化数は、-1→0と変化し、臭素$\ce{Br}$の酸化数は、0→-1と変化しています。
このことから、酸化力の強弱がわかります。
$\quad \ce{ Br2 > I2}$
もちろん、これらは酸化還元反応です。
(4)$ \quad \ce{SO2 + 2H2S → 3S + 2H2O}$
硫化水素$\ce{H2S}$の$\ce{S}$は、$\ce{S}$が取りうる最低の酸化数-2であり(下の【付録:原子番号と酸化数の関係】を参照)、非常に酸化されやすく強い還元作用を示します。
酸化数の変化 $\ce{SO2}$の$\ce{S}$:+4→0 $\ce{H2S}$の$\ce{S}$:-1→0
酸化剤:$\ce{SO2}$ 還元剤:$\ce{H2S}$
(5)$ \quad \ce{2FeSO4 + H2SO4 + H2O2→Fe2(SO4)3 + 2H2O}$
硫酸鉄(Ⅱ)$\ce{FeSO4}$水溶液を電気分解すると、硫酸鉄(Ⅲ)$\ce{Fe2(SO4)3}$と過酸化水素$\ce{2H2O}$、硫酸$\ce{H2SO4}$が生成します。
この反応は酸化還元反応で、水溶液の電気分解 (水=還元剤)に分類されます。
$\ce{SO4}$が2価の陰イオンであることから
$\ce{FeSO4}$は
$\quad \ce{Fe:SO4=1:1}$
ゆえに、$\ce{Fe}$は2価になります。
$\ce{Fe2(SO4)3}$は、
$\quad \ce{Fe:SO4=2:3}$
ゆえに、$\ce{Fe}$は3価になります。
| 還元剤 Reducing agent | 酸化剤 Oxidiziing agent | |
| 相手を | 還元させる・する | 酸化させる・する |
| 自分自身は | 酸化する | 還元する |
| 自分は電子を | 放出する (与える・失う) X loses electrons |
受け取る (奪い取る・得る) Y gains electrons |
| 酸化数は Oxidation Number |
増える becoms more positive |
減る becomes more negative |
酸化数が負の値の場合、中性の原子よりも電子を得ている状態となっています。
また、酸化数が正の値の場合、中性の原子よりも電子を失っている状態となっています。
また、酸化数が増加した原子は酸化されたと呼ばれます。
酸化数が減少した原子は還元されたと呼ばれます。
そのため、酸化還元反応を扱う場合、酸化数はとても便利な数といえます。
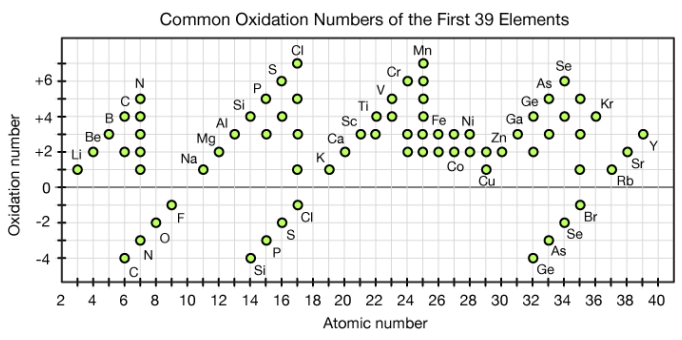
【付録:原子番号と酸化数の関係】
Dokugeki.com hopes you will successfully complete poisonous and deleterious substance handler test.
I would be delighted if this website is helpful for you to obtain the license.
Fortune prefers a person who has prepared minds.
Copyright (C) Since 2015 毒物劇物取扱者.com All Rights Reserved.