毒劇ドットコム
毒物劇物取扱者.com
複数条件の場合はキーワードの間にスペースを入れてください。例 特定毒物 劇物
毒物劇物取扱者試験問題
酸化と還元3
問題
酸化還元反応に関する化学式として、不適切なものは次のうちどれか。
オリジナル
解 説
ぱっと見た感じ、分子単体が存在している式は、酸化還元反応だと思います。
単体がないから
(4)$ \quad \ce{AgNO3 + NaCl → NaNO3 + AgCl}$
怪しいので、チェックしてみます。
1.化合物中の酸化数の和は、0である
2.アルカリ金属の酸化数は+1、アルカリ土類金属は+2
3.ハロゲンの酸化数は、原則-1である
4.水素の酸化数は+1
5.酸素の酸化数は、-2である(過酸化水素中の酸素の酸化数は-1とする)
反応前後での酸化数の変化を見てみます。
$\ce{Ag : +1 → +1}$
$\ce{N : +5 → +5}$
$\ce{O : -2 → -2}$
$\ce{Na : +1 → +1}$
$\ce{Cl : -1 → -1}$
どの原子も酸化数は変化していません。
よってこの反応は酸化還元反応ではなく、単なるイオン反応になります。
塩化ナトリウム水溶液に硝酸銀水溶液を加える化学反応式
$\ce{NaCl + AgNO3 → AgCl↓ + NaNO3}$
塩化ナトリウム + 硝酸銀(I) → 塩化銀(I) + 硝酸ナトリウム
沈殿が出来て固体が沈んでいます。
その固体は溶解度が小さい物質であるということになります。
逆に矢印のついていない$\ce{NaNO3}$は水によく溶ける物質であるという事になります。
$\ce{NaCl}$も$\ce{AgNO3}$も水によく溶ける物質です。
だから混ぜる前は濁りのない、透明な溶液です。
イオン性物質は水に溶けていればイオンに分かれています。
$\ce{AgCl}$以外では化学式の通りの形でくっついて存在しているイオンはないのです。
全て別々です。
混ぜる前は$\ce{Na^+}$、$\ce{Cl^-}$、$\ce{Ag^+}$、$\ce{NO3^-}$がばらばらになって存在しています。
混ざるとこの中の$\ce{Ag^+}$と$\ce{Cl^-}$が結合し沈殿します。
$\ce{Na^+}$と$\ce{NO3^-}$はばらばらのまま溶液の中に残っています。
変化したものだけ抜き出すと、
$ \quad \ce{Ag^+ + Cl^- → AgCl↓}$
です。
$\ce{Na^+}$と$\ce{NO3^-}$が結合し$\ce{NaNO3}$が出来たわけではありません。
$ \quad \ce{NCl + NaOH → NaCl + H2O}$
の反応で「$\ce{NaCl}$が出来た」とか「$\ce{Na^+ }$と$\ce{Cl^-}$が結合して」とか書く人がいます。
できたのは$\ce{H2O}$です。
$\ce{Na^+}$と$\ce{Cl^-}$は別々のままなのです。
(1)$\quad \ce{2Na + 3H2O → 2NaOH + H2}$
ナトリウムが水に酸化され、水分子中の水素が還元される反応
(2)$\quad \ce{2KI + Cl2 → 2KCl + I2}$
ヨウ化カリウムと塩素水の反応
(3)$\quad \ce{2H2S + O2 → 2S + 2H2O}$
硫化水素水と酸素 の反応
(5)$\quad \ce{SO2 + Cl2 + 2H2O → H2SO4 + 2HCl }$
二酸化硫黄は、水分の存在下で塩素と反応して、硫酸と塩酸を生成
目の付け所は、式の中に“単体”があるかどうかです。
単体が化学反応すると、まず間違いなく“酸化還元反応”です。
(1)の、$\ce{Na}$、$\ce{H2}$、(2)の$\ce{Cl2}$、$\ce{I2}$、(3)の$\ce{O2}$、$\ce{S}$、(5)の$\ce{Cl2}$のように、1種類だけの元素記号だけで表される物質です。
“単体の酸化数は、0”なので、反応の前後で、酸化数が変化するのです。
ちなみに、単体の酸化数の変化は、
$\ce{Na: 0→+1}$
$\ce{H: +1→0}$
$\ce{Cl:0→-1}$
$\ce{I: -1→0}$
$\ce{O: 0→-2}$
$\ce{S: -2→0}$
$\ce{Cl: 0→ -1}$
酸化還元反応です。
酸化数が負の値の場合、中性の原子よりも電子を得ている状態となっています。
また、酸化数が正の値の場合、中性の原子よりも電子を失っている状態となっています。
また、酸化数が増加した原子は酸化されたと呼ばれます。
酸化数が減少した原子は還元されたと呼ばれます。
そのため、酸化還元反応を扱う場合、酸化数はとても便利な数といえます。
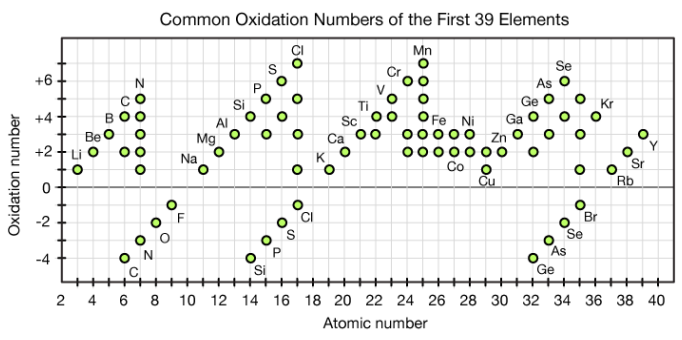
【付録:原子番号と酸化数の関係】
Dokugeki.com hopes you will successfully complete poisonous and deleterious substance handler test.
I would be delighted if this website is helpful for you to obtain the license.
Fortune prefers a person who has prepared minds.
Copyright (C) Since 2015 毒物劇物取扱者.com All Rights Reserved.