毒劇ドットコム
毒物劇物取扱者.com
複数条件の場合はキーワードの間にスペースを入れてください。例 特定毒物 劇物
毒物劇物取扱者試験問題
酸化と還元1
問題
酸化と還元に関する記述として、適切なものは次のうちどれか。
千葉県
解 説
(1)物質が水素を失ったとき、その物質は還元されたという。
選択肢(1)は不適切です。
正しくは以下の通りです。
物質が水素を失ったとき、その物質は酸化されたという。
(2)還元剤は相手物質を酸化し、還元剤自身は還元される物質である。
選択肢(2)も不適切です。
正しくは以下の通りです。
還元剤は相手物質を還元し、還元剤自身は酸化される物質である。
(3)水分子の水素原子の参加数は0である。
選択肢(3)も不適切です。
正しくは以下の通りです。
水分子の水素原子の参加数は+1である。
水 $\ce{H2O}$ の場合、水素原子$\ce{ H}$ の酸化数は$\ce{+1}$、酸素原子$\ce{ O}$ の酸化数は$\ce{-2}$、となります。
ただし、過酸化水素 $\ce{H2O2}$ の酸素 $\ce{O}$ の酸化数は、$\ce{-1}$になります。
(4)物質が電子を失うとき、その物質は酸化されたという。
選択肢(4)が適切です。
(5)化合物中の成分元素(原子)の酸化数の総和は1である。
選択肢(5)は不適切です。
正しくは以下の通りです。
化合物中の成分元素(原子)の酸化数の総和は0である。
化学初心者を悩ます最大の難関といえる”酸化と還元”です。
当Webサイト管理人もこれを理解するに大変苦労した苦い思いであります。
少々愚痴っぽくなりますが、言葉が何が何だかわかりませんでした。
酸化する、酸化される、電子を奪う、電子を放出する、電子を受け取る と最初何が何だかさっぱりわかりませんでした。
この言葉で、どれだけの化学初学者が挫折し、この分野から去っていったのかかなり膨大な人数だと想像されます。
だから、このサイトでは誰でもわかりやすくわかりやすく説明しようとしているのは、化学学習難民を少しでも減らしたい願望があるからです。
毒物劇物取扱者試験は、仕事でも必要なことはもちろんのこと、化学学習難民を救済するにはうってつけの資格だと思うのであります。
下手な説明でありますが、なんとなくわかったような気になったと思ってくだされば、当方の願いが叶ったようなものであります。
ささやかな夢を語らせて頂きました。
それでは本題に入らせていただきます。
アレニウスは酸・塩基を以下のように定義しました。
酸は、水に溶けると水素イオン$\ce{H^+}$を生じる物質であり、塩基は、水に溶けると水酸化物イオン$\ce{OH^-}$を生じる物質である。
例
$\ce{HCl → H^+ + Cl^-}$
$\ce{NaOH → Na^+ + OH^-}$
これをブレンステッドとローリーは水溶液以外にも適用できるように拡張し、
酸とは、水素イオン$\ce{H^+}$を与える物質であり、塩基とは、水素イオン$\ce{H^+}$を受け取る物質である。
と定義しました(Bronsted-Lowry Acid Definition)。
$\ce{HCl + H2O → H3O^+ + Cl^-}$
$\ce{NH3 + H2O → NH4^+ + OH^-}$
$\ce{HCl}$は$\ce{H2O}$に$\ce{H^+}$を与えているので酸、$\ce{H2O}$は$\ce{H^+}$を受け取っているので塩基です。
$\ce{NH3}$は$\ce{H2O}$から$\ce{H^+}$を受け取っているので塩基、$\ce{H2O}$は$\ce{H^+}$を 与えているので酸です。
選択肢(1)は、アレニウス、ブレンステッドとローリーの定義が分かっているか問うものでした。
(1)物質が水素を失ったとき、その物質は酸化されたという。
言葉比べで、水素イオンを失った とか 水素イオンを与えて で、これが化学初学者に混乱を生じさせるの諸悪の根源なのであるのです。
酸化数の決め方のルール
酸化数の基礎は、電子数をベースとした表記法なのですが、電子のやりとりというものは、どんな化学反応でも明確であるといえないです。
例えば
$\ce{ C + O2 → CO2}$
酸素分子のように分子が関わる酸化還元反応では電子のやりとりがはっきりしないのです。
二酸化炭素と同様に水分子$\ce{H2O}$ のような共有結合でできている分子が関わる酸化還元反応では、電子の授受の関係がわかりにくいのです。
もし水素$\ce{H2}$が酸化されたと仮定すると、水素$\ce{H2}$は水素イオン$\ce{H^+}$ となって、
(典型的な例:$\ce{2H2 + O2 → 2H2O}$)
$\ce{ 2H2 → 4H^{+} + 4e^-}$
電子$\ce{4e^-}$ を酸素$\ce{O2}$に受け渡します。
そして酸素$\ce{O2 }$は、
$\ce{O2 + 4 e^{‒} → 2 O^{2–}}$
水素$\ce{2H2}$から電子$\ce{4e^-}$ を受け取って、酸化物イオン$\ce{2O^{2-}}$ になるはずなのです。
実際には、水分子$\ce{H2O}$はそのような水素イオン$\ce{H^+}$ と酸化物イオン$\ce{O^{2ー}}$ によるイオン性の化合物になって存在してはいません。
水分子$\ce{H2O}$は共有結合性の化合物として存在しています。
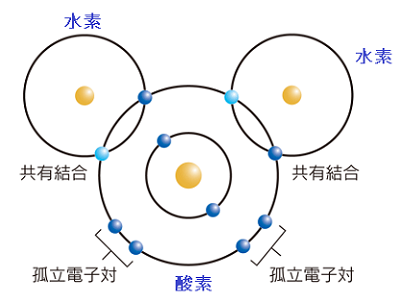
【酸素 $\ce{_{8}O \quad (1s^2 \ 2s^2 \ 2p^4)}$ 水素 $\ce{_{1}H \quad (1s^1)}$】
水分子は共有結合によってできていると述べました。
しかし、量子力学によれば $\ce{H}$ 原子と$\ce{ O}$ 原子はわずかにイオンの性質を持つことがわかっっています。
酸化還元反応では、わずかなイオン性は無視され、水分子$\ce{H2O}$の電子の授受での酸化還元反応のはなしはしないことになっています。
$\ce{H2O}$ は水の中で次のように電離して平衡に達します。
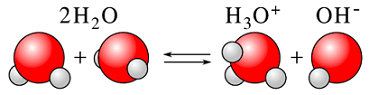
$ \qquad \qquad \quad \ce{H2O + H2O \leftrightarrows H3O^+ + OH^-}$
$\ce{H2O}$ はブレンステッド・ローリーの酸として働いて $\ce{H^+}$を与えて、$\ce{OH^-}$となっているので、共役塩基は $\ce{OH^-}$であるといいます。
片方の$\ce{H2O}$が塩基として$\ce{H^+}$を得て$\ce{H3O^+}$を形成し、もう一方の$\ce{H2O}$は酸として$\ce{H^+}$を失い$\ce{OH^-}$を形成します。
水は酸と塩基の両者になります。
オキソニウムイオン $\ce{H3O^+}$:水分子に水素イオンがひとつ配位結合した化学種(←出題する県もある)
電子の授受による酸化還元反応は、水、二酸化炭素などの場合、説明が非常に厄介なものになっていて困っていました。
それで、ウェンデル・ラティマーさんがうまいこと、酸化数の概念を提唱しました。
酸化数は、物質中の原子やイオンの酸化の程度を数値で表したものです。
ある原子やイオンが酸化状態にある場合、酸化数は正の値をとり、その値が大きいほど電子不足の状態にあることを示しています。
逆に還元状態にある場合には負の数値をとり、その値が大きいほど電子過剰の状態にあることを示しています。
酸化数とは、物質のもつ電子が基準よりもどれだけ増減したかを表す数値となっています。
あくまでも電子数の基準に対する増減を表しているので、「1」の場合は「+1」とプラスの場合も符号をつけて表します。
しっかり符号を付けないと(符号なしの絶対値だと)、増えたのか減ったのかがわかなくなります。
硬い言い方をすれば、酸化数とは酸化状態とも呼ばれ、原子が別の原子と化学結合を形成するために獲得または喪失する電子の総数のことをいいます。
酸化数の決め方には規則があります。
酸化数は、注目した原子 1 個分の数値とし、必ず整数で表し、0以外は必ず+、-の符号をつけます。
- 単体中の原子の酸化数は$\ce{0}$とする。
例えば、水素 $\ce{H2}$ の水素原子 $\ce{H}$ の酸化数は$\ce{0}$で、銅原子 $\ce{Cu}$ の酸化数は$\ce{0}$となります。
- 単原子イオンの酸化数は、そのイオンの電荷に等しい。
イオン価の分だけ電子を失っている、あるいは得ているからです。
例えば、銅(Ⅱ)イオン $\ce{Cu^{2+}}$ の酸化数はそのイオンの電荷に等しいので、銅(Ⅱ)イオンの酸化数は$\ce{+2}$となります。
塩化物イオン $\ce{Cl^-}$でしたら、酸化数は$\ce{-1}$です。
- 化合物中の水素原子の酸化数を$\ce{+1}$、酸素原子の酸化数を$\ce{-2}$とする。
例えば、水 $\ce{H2O}$ の場合ですが、水素原子 $\ce{H}$ の酸化数は$\ce{+1}$、酸素原子 $\ce{O}$ の酸化数は$\ce{-2}$、となります。
ただし、過酸化水素 $\ce{H2O2}$ の酸素 $\ce{O}$ の酸化数は、$\ce{-1}$になります。
$ \quad \ce{H2O : 2(+1) + (-2) = 0}$
$ \quad \ce{H2O2: 2(+1) + 2(-1) = 0}$
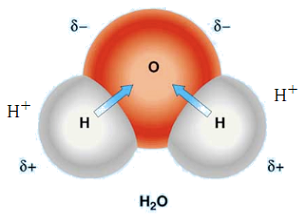
水分子で酸素と水素の電気陰性度を比べると、酸素が3.44、水素が2.2です。
酸素が二個の水素の電子を引き付けてしまって、電子過剰で酸化数が”-2”とみなせます。
一方、水素は電子をもっていかれてしまったので、電子不足でそれぞれの水素の酸化数が”+1”というふうに見立てることができます。
- 化合物中の原子の酸化数の総和は$\ce{0}$とする。
$ \quad \ce{SO2: (+4) + 2(-2) = 0}$
- 多原子イオン中の原子の酸化数の総和は、そのイオンの電荷に等しい。
$ \quad \ce{SO4^{2-}: (+6) + 4(-2) = -2}$
選択肢(3)と(5)は、酸化数に関するルールを問いただすものです。
酸化数の変化と酸化・還元について
酸化数の変化と酸化・還元について考えてみます。
酸化還元反応の場合、水素 $\ce{H2}$ が水 $\ce{H2O}$ になる変化を酸素のやりとりで考えた場合、水素 $\ce{H2}$ は酸素と結合したので、水素 $\ce{H2}$ は酸化されたと表現します。
$\ce{2H2 + O2 → 2H2O}$
このとき、水素の酸化数は$\ce{0}$から$\ce{+1}$に増えています。
したがって、”酸化数の増加”は”酸化された”と表せるのです。
ウェンデル・ラティマーさんが提唱した”酸化数”のおかげで、電子の授受による酸化還元反応に執着することなく、うまいこと水の酸化について説明できました。
また、酸化銅(Ⅱ)$\ce{CuO}$ が銅 $\ce{Cu}$ になる変化は、酸化銅(Ⅱ)$\ce{CuO}$ が還元された変化です。
$\ce{CuO + H2 → Cu + H2O}$
このとき銅 $\ce{Cu}$ の酸化数が$\ce{+2}$から$\ce{0}$に減る訳ですから、”酸化数の減少”は”還元された”と表すわけです。
酸化・還元を酸化数の増加・減少で考えるのは、電子のやりとりがはっきりしない分子からなる物質同士の反応の場合にとても有益です。
例えば
$\ce{C + O2 → CO2}$
の酸化数の増加・減少を調べるとどうでしょうか。
炭素$\ce{C:0 → +4}$
より、酸化数は増加しており”炭素$\ce{C}$は酸化された”となります。
当然、炭素は酸素と結合しているので、酸素のやりとりで考えても酸化されています。
また
酸素 $\ce{O:0 → -2}$
なので、酸化数は減少しているので、酸素$\ce{O2}$は還元されたとなります。
酸化剤・還元剤
繰り返しになりますが、酸素原子による酸化還元の定義では、物質が酸素原子を受け取ったとき、その物質は”酸化された”といい,酸素原子を失ったとき、その物質は”還元された”という言い方をします。
また、ある原子の酸化数が増えれば、その原子は”酸化された”といいます。
逆に,ある原子の酸化数が減れば、その原子は””還元された”といいます。
酸化銅(Ⅱ)$\ce{CuO}$ と水素$\ce{ H2}$ が反応するときを例に先に挙げました。
$\ce{H2}$ は $\ce{CuO}$ から酸素原子を受け取って水 $\ce{H2O}$ になったので,$\ce{H2}$ は”酸化された”ということができます。
一方、$\ce{CuO}$ は酸素原子を失って銅 $\ce{Cu}$ になったので、$\ce{CuO}$ は”還元された”ということができます。
このとき、$\ce{CuO}$ は $\ce{H2}$ を”酸化した”ので”酸化剤(oxidizing agent、oxidant)”、$\ce{H2}$ は $\ce{CuO}$ を”還元した”ので”還元剤(reducing agent、reductant)”です。
このように、酸化還元反応の中には,物質を酸化する”酸化剤”と還元する”還元剤”が必ず関わっています。
ちなみにoxidizeは、酸化させる、酸化する、 oxidizingは酸化、reducingは還元、撲殺、 agent は 剤 、代理業者、斡旋者、仲立ち、中継ぎ人、 取扱人とかの意味です。
選択肢(2)は酸化・還元の基礎を問うものでした。
(2)還元剤は相手物質を酸化し、還元剤自身は還元される物質である。
電子のやり取りでの酸化と還元
"酸化数"による酸化還元反応と電子の授受による酸化還元反応の説明が行ったり来たりですみません。
あらためて、酸化還元反応は電子の受け渡しで考えることもできます。
電子を失ったとき、その物質は”酸化された”といい、電子を受け取ったとき、その物質は”還元された”といいます。
相手の物質から電子を受け取り、相手を酸化する物質を”酸化剤”といいます。
それによって酸化剤自身は還元されます。
一方、相手の物質に電子を与えて、相手を還元する物質を”還元剤”といいます。
そのため、還元剤自身は酸化されます。
選択肢(4)は、電子のやり取りでの酸化と還元を問うものでした。
(4)物質が電子を失うとき、その物質は酸化されたという。
表にまとめました。
| 還元剤 Reducing agent | 酸化剤 Oxidiziing agent | |
| 相手を | 還元させる・する | 酸化させる・する |
| 自分自身は | 酸化する | 還元する |
| 自分は電子を | 放出する (与える・失う) X loses electrons |
受け取る (奪い取る・得る) Y gains electrons |
| 酸化数は Oxidation Number |
増える becoms more positive |
減る becomes more negative |
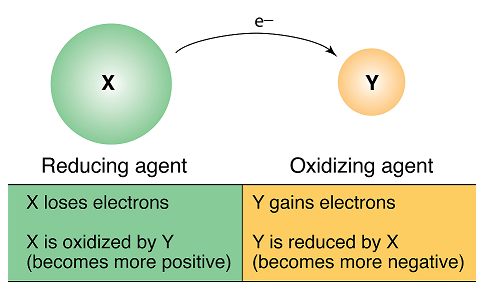
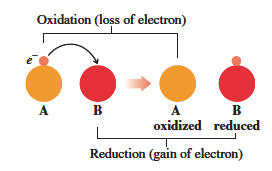
酸化数が負の値の場合、中性の原子よりも電子を得ている状態となっています。
また、酸化数が正の値の場合、中性の原子よりも電子を失っている状態となっています。
また、酸化数が増加した原子は酸化されたと呼ばれます。
酸化数が減少した原子は還元されたと呼ばれます。
そのため、酸化還元反応を扱う場合、酸化数はとても便利な数といえます。
酸化還元がわけわからなくなったら野球のキャッチ・ボールを思い出してください。
酸化還元反応はいわば電子というボールのキャッチ・ボールです。
酸化と還元は必ず同時に起こります(ピッチャーとキャッチャーが両方いないとキャッチ・ボールは成立しない)。
還元剤は酸化剤に電子を投げるピッチャー、酸化剤は還元剤から電子を受け取るキャッチャーです。
還元剤は酸化剤に電子を投げて(酸化剤を還元して)自身は電子を失い酸化され、酸化剤は還元剤から電子を受け取り(還元剤を酸化して)自身は電子を得るので還元されます。
それでも、還元と還元剤がこんがらかったら、原点に戻り還元を確認しましょう。
$\ce{Cl2 + 2e → 2Cl^-}$
を思い出し、$\ce{Cl2}$が電子$\ce{2e}$を受け取っているので還元されたを確認してください。
塩素$\ce{Cl:0 → -1} \quad$ 酸化数が減っている! 還元だ!!
それでもわかんなくなったら、
左辺で電子を受け取ったら”還元”と思い出しましょう。
長々と述べましたが、かえって化学アレルギーが増えてしまっては本末転倒です。
説明が本当に下手で困りますね。
努力だけは勘弁してもらえたら嬉しいです。
電子の移動という発想は、化学の根本原理・本質でこれを発見した科学者はとても凄い人だなとつくづく思います。
電子$e=1.6 \times 10^{-19} C (=A s)$を酸化数の世界ではこれを1と数えると、いろいろと説明がつくと思い立った人も凄いなと思いました。
【付録:原子番号と酸化数の関係】
Dokugeki.com hopes you will successfully complete poisonous and deleterious substance handler test.
I would be delighted if this website is helpful for you to obtain the license.
Fortune prefers a person who has prepared minds.
Copyright (C) Since 2015 毒物劇物取扱者.com All Rights Reserved.